В настоящее время многие развитые страны мира включили в Национальные программы иммунизации вакцину против гемофильной инфекции, вызванной бактерией Haemophilus influenzae тип b. Основными признаками Hib-инфекции являются тяжелая пневмония, менингит и другие инвазивные заболевания у детей до 5 лет. До введения вакцинации серьезные заболевания были зафиксированы у 8.13 млн. детей в возрасте 1–59 месяцев, смертность составила – 371 000 человек [1]. Начиная с 90-х годов ХХ ст., после начала иммунизации Hibвакциной, заболеваемость гемофильной инфекцией значительно снизилась (более чем на 90 %) [1]. В Российской Федерации вакцинация против Hibинфекции осуществляется только детям из группы риска. В первую очередь это связано с отсутствием полного цикла производства вакцины против H. influenzae тип b на территории нашей страны.
Важной составляющей любого биотехнологического процесса является высокоактивный штамм-продуцент. Работа по изолированию, идентификации и изучению штаммов H. influenzae тип b ведется уже более 70 лет, а постоянное усовершенствование технологий, использование современного оборудования позволяют значительно повышать синтез целевых метаболитов продуцентов. Цель настоящего обзора – обобщить данные литературы о свойствах, особенностях и местах выделения, идентификации, продуктивности описанных штаммов H. influenzae тип b, а также сравнить эти сведения с собственными результатами, полученными на базе ФГУП «СанктПетербургский научно-исследовательский институт вакцин и сывороток и предприятие по производству бактерийных препаратов» ФМБА России (ФГУП СПбНИИВС ФМБА России).
Общая характеристика H. influenzae тип b.
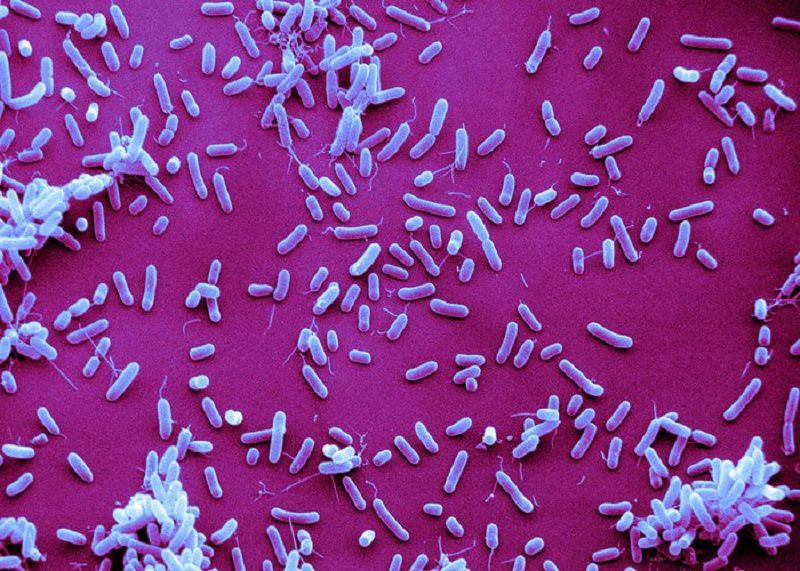
Бактерии H. influenzae тип b относятся к грамотрицательным палочкам овоидной формы и вызывают ряд заболеваний у человека. Согласно книге Prokaryotes [2] типы вида H. influenzae впервые были выделены в 1889 г. во время эпидемии гриппа и описаны Пфайфером. Долгое время именно они считались возбудителями гриппа. В 1920 г. Winslow с соавтор. предложили название Haemophilus, а в 1933 г. Smith с соавтор. установили вирусную природу гриппа, а также то, что инфекция, вызванная H. influenzae была иного происхождения [3]. Однако наименование вида («influenzae», что в переводе означает «грипп») за данными микроорганизмами закрепилась. На протяжении долгого времени данный вид менял свой таксономический статус, пока в 1984 г. не был окончательно включен в семейство Pasteurellaceae. H. influenzae тип b синтезирует капсульный полисахарид, состоящий из повторяющихся единиц 5-D-рибитол-(1→1)-β-D-рибоза-3-фосфата (рисунок) и названный полирибозилрибитолфосфатом (ПРФ) [4, 5]. Впервые структура капсульного полимера была описана в 1953 г. Zamenhof с соавтор. [6], однако в его составе выделяли только полирибозилфосфат. Наличие рибитола в структуре полисахарида было установлено в 1975 г. Crisel с соавтор. при помощи бумажной хроматографии и ядерно-магнитного резонанса [7].
Основываясь на структуре капсульного полисахарида H. influenzae тип b, микроорганизмы данного серотипа также разделяются на две группы – тип I и тип II – причем большинство клинических изолятов относится к первому типу [8]. При помощи сиквенса генов hcsA и hcsB исследователи определяли принадлежность изолятов, выделенных от больных гемофильной инфекцией в Иране, к определенному генотипу. Установлено, что среди 50 исследованных культур H. influenzae четыре относились к серотипу b, половина из которых принадлежала ко II типу. Полученные результаты подчеркивают необходимость проведения таких исследований с целью усовершенствования вакцинопрофилактики [8].
По способности вызывать иммунный ответ капсульный полисахарид относится к Т-независимым антигенам 2-го типа, которые стимулируют образование антител без помощи главного комплекса гистосовместимости II класса. ПРФ запускает активацию комплементарного фактора C3d по комплимент альтернативному пути, в следствии чего примированные В клетки маргинальной зоны перемещаются в зародышевый центр и контактируют с комплексом полисахарид-C3d через CD21 рецептор комплимента [9].
Виды, относящиеся к роду Haemophilus, являются факультативными анаэробами. Клетки неподвижны и не образуют спор, оксидазоположительны и являются мезофилами – оптимальная для роста температура 35–37 °С. Для культивирования представителей рода Haemophilus используют натуральные (например, сердечно-мозговой бульон), синтетические и полусинтетические питательные среды, содержащие неорганические соли, глюкозу, пептон [10–14].
Выделение и идентификация H. influenzae тип b.
В основном источниками выделения H. influenzae (в том числе и серотипа b) являются цереброспинальная жидкость, кровь, мокрота, ушная жидкость и верхние дыхательные пути детей, имеющих гемофильную инфекцию [4]. После изолирования определяют принадлежность представителей рода Haemophilus к определенному виду и серотипу. Идентификацию микроорганизмов, как правило, проводят общепринятыми методами по морфолого-культуральным, физиолого-биохимическим, генетическим и серологическим признакам [11, 15–17].
Известно, что H. influenzae тип b обладает рядом уникальных отличительных особенностей и свойств, благодаря которым данный микроорганизм можно идентифицировать. Традиционно считается, что представители рода Haemophilus для своей жизнедеятельности требуют Х (гемин) и V (никотинамидадениндинуклеотид, НАД) факторы и это является их отличительной особенностью, однако на данный момент установлено, что некоторые виды Actinobacillus и Pasteurella также нуждаются в V факторе [15]. Относительно H. influenzae тип b, данный вид способен расти только в присутствии данных двух факторов. В зависимости от вида и штамма большинство других представителей рода Haemophilus требуют для роста только один из них [15].
При использовании этого метода для идентификации H. influenzae тип b возникает трудность, связанная с тем, что потребность в Х и V факторах для данного вида одинакова с H. haemolyticus. В таком случае для их различия необходимо использовать дополнительные исследования, например, проверка типа гемолитической реакции. Известно, что H. haemolyticus способен к β-гемолизису, что подтверждается по результатам дополнительного теста на кровяном агаре [15, 17].
Потребность штаммов H. influenzae в порфиринах различной структуры, а также влияние функциональных групп в их составе начали изучать еще в середине прошлого века [18]. Потребность в факторе X у H. influenzae обусловлена тем, что клетки данного микроорганизма не способны синтезировать фермент, превращающий δ-аминолевулиновую кислоту (АЛК) в протопорфирин IX (интермедиаты пути биосинтеза гема) [4]. Поэтому для роста представителей H. influenzae тип b в питательную среду обязательно необходимо вносить источник протопорфирина IX, например, в виде гемина. Установлено, что у H. influenzae присутствует активная феррохелатаза, которая катализирует введение двухвалентного железа в ядро протопорфирина с образованием гема. Предполагается, что оптимальная концентрация гема для роста H. influenzae – 0.1–10 мкг/мл. НАД участвует в окислительно-восстановительных реакциях в клетке H. influenzae [4]. У H. influenzae полностью отсутствует биосинтетический путь получения НАД de novo. Накоплено достаточно информации о влиянии НАД на рост H. influenzae тип b при внесении фактора роста в питательную среду, однако мало информации о поглощении и преобразовании фактора V in vivo. Авторы [19] установили, что генетическая последовательность nad N у H. influenzae тип b Eagan отвечает за катаболизм НАД и его преобразование в никотинамидрибозид. Потребность в факторе V удовлетворяется путем внесения НАД или его производных в количестве 0.2–1.0 мкг/мл.
Кроме того, виды рода Haemophilus отличают по способности лизировать лошадиные эритроциты, присутствию каталазы и ферментативной активности в отношении сахаров [15–17]. На основе биохимических реакций, наличию уреазы, орнитиндекарбоксилазы и по продукции индола штаммы H. influenzae разделяют на биотипы. Всего различают восемь биотипов H. influenzae (I–VIII). Большинство изолятов типа b относятся к биотипу I, тогда как основная часть нетипируемых штаммов – к биотипу II–VI [16].
Учитывая метаболические особенности, представителей рода Haemophilus традиционно выращивают на шоколадном агаре, который получают путем добавления 5–10 % дефибринированной крови к основе кровяного агара. Смесь выдерживают при 80 °С в течение 15–20 мин до приобретения средой темнокоричневого цвета, напоминающего шоколад. Такое нагревание способствует высвобождению НАД из красных кровяных телец, а также приводит к инактивации НАД-разрушающих ферментов. В некоторых случаях в качестве источников НАД используют добавки, например, Isovitale X, а гемина – раствор гемоглобина [4, 16, 17]. Возможно приготовление шоколадного агара в лабораторных условиях из основы шоколадного агара с добавлением раствора гемоглобина и добавки, содержащей необходимые факторы роста. Также используют коммерческие готовые чашки со средой, в состав которых к основе – гонококковому агару – добавлен гемин и смесь различных добавок. При росте на шоколадном агаре H. influenzae тип b образует большие, круглые, гладкие, выпуклые, сероватые непрозрачные колонии [17]. Недостатком использования шоколадного агара для идентификации является невозможность наблюдения гемолитических свойств выделенной культуры, что не позволяет разделить различные виды рода Haemophilus [4].
Все признаки, характерные для H. influenzae, и позволяющие дифференцировать данный вид среди других представителей рода, представлены в определителе бактерий Берджи [15]. Необходимо отметить, что основной и наиболее простой способ определения серотипа b гемофильной палочки – реакция агглютинации со специфической сывороткой [16, 17]. Обобщенная схема по идентификации представителей рода Haemophilus предложена в работе [16]. Предварительно образцы материала высевают на кровяной или шоколадный агар, изучают морфолого-культуральные свойства полученной культуры и проводят ряд биохимических тестов (на оксидазу, каталазу, уреазу, рост в присутствии Х и V факторов).
Центром по контролю и профилактике заболеваний США для идентификации именно серотипа b H. influenzae предложена схема, включающая высев материала на шоколадный агар, изучение культуральных свойств полученных колоний, тест на оксидазу, рост в присутствии Х и V факторов, агглютинацию с сывороткой, специфичной к серотипу b. В случае положительных результатов делают предварительный вывод, что изолированная культура – H. influenzae тип b и при необходимости проводят дополнительные исследования (например, генетические) [17]. В настоящее время учеными предлагается использовать инструментальные методы для идентификации серотипа b. Так, в статье [20] описаны результаты применения времяпролетной массспектрометрии с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF MS), которая позволила идентифицировать штаммы, относящиеся к H. influenzae тип b, с высокой чувствительность (100 %), специфичностью (99 %) и воcпроизводимостью (98 %).
Ранее сотрудниками ФГУП СПбНИИВС ФМБА России был получен клинический изволят путем смыва свабом со слизистой из носоглотки больного ребенка. Из клинического изолята при помощи последовательного пассирования на твердой (шоколадный агар) и жидкой питательной среде выделили чистую культуру H. influenzae тип b. После изучения морфолого-культуральных, физиолого-биохимических, серологических и генетических (анализ последовательности генов 16 S rRNA) свойств было доказано, что изолированная культура относится к виду Haemophilus influenzae и обладает серотипом b [21].
Данный штамм был депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ – Оболенск» Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» (ФБУН ГНЦ ПМБ) для целей национальной патентной процедуры под регистрационным номером В-7884. Область применения штамма обозначена как: высокоактивный продуцент капсульного полисахарида (полирибозилрибитолфосфата), используемый для промышленного производства. Максимальная продуктивность H. influenzae тип b В-7884 по полисахариду при оптимальных условиях составила 290–300 мкг/мл. Получены и охарактеризованы по всем соответствующим показателям Главный и Рабочий банки клеток H. influenzae тип b В-7884, а также проведена отработка процесса культивирования штамма.
СПИСОК ЛИТЕРАТУРЫ
1. Всемирная организация здравоохранения // Еженедельный эпидемиологический бюллетень. 2013. Т. 88. С. 413-428.
2. Dworkin M., Falkow S., Rosenberg E., Schleifer K.-H., Stackebrandt E. The Prokaryotes. Springer. New York, 2006, vol. 6, 1194 p.
3. Centers for disease control and prevention. Epidemiology and prevention of vaccine-preventable Diseases. Haemophilus influenzae type b. Режим доступа: https://www.cdc.gov/vaccines/pubs/pinkbook/ hib.html#vaccines (дата обращения: 13.03.2017).
4. Богданович Т.М., Стецюк О.У., Кречикова О.И., Боронина Л.Г., Катосова Л.К., Фаустова М.Е., под редакцией Страчунского Л.С. // Клиническая микробиология и антимикробная химиотерапия. 2000. Т. 2. № 2. С. 93-109.
5. Riza A., Nurainy N. // Proceed. Intern. Semin. Chemist. 2008, pp. 294-296.
6. Zamenhof S., Leidy G., Fitzgerald P. L., Alexander H.E., Chargaff E. // J. Biol. Chem. 1953. Vol. 203. N 2, pp. 695-704.
7. Crisel R.M., Baker R.S., Dorman D.E. // J. Biol. Chem. 1975. Vol. 250. N 13, pp. 4926-4930.
8. Bagherzadeh Khodashahri S., Siadat S.D., Rahbar M., Abdollahpour-Alitappeh M., Vaziri F., Rahnamaye-Farzami M., Mohammadzadeh M., Davari M., Fateh A., Masoumi M. // Iran J. Microbiol. 2015. Vol. 7. N 3, pp. 136-143.
9. Zarei A.E., Almehdar H.A., Redwan E.M. Hib Vaccines: Past, present, and future perspectives. Режим доступа: https://www.cdc.gov/vaccines/ pubs/pinkbook/hib.html#vaccines (дата обращения: 13.03.2017).
10. Afshar M., Esmaily F., Aminian M., Asli E., Haadi A., Torabi M., Hatami A. // Arch. Razi Inst. 2012. Vol. 67. N 1, pp. 7-12.
11. Hamidi A., Beurret M.F. Patent United States, N 7,582,459 B2, 2004.
12. Ella K. M., Ramasamy V., Naidu M. G., Sarma A. D. Patent WO, N 2014009971, 2014.
13. Елкина С.И., Сергеев В.В., Ванеева Н.П. Апарин П.Г., Львов В.Л., Ястребова Н.Е., Орлова О.Е. Патент РФ, № 2257412, 2005.
14. Anderson P., Pitt J., Smith D.H. // Infect. Immun. 1976. Vol. 13. N 2, pp. 581-589.
15. Заварзин Г.А. Определитель бактерий Берджи. Москва, Мир, 1997, Т. 1, 2, 800 с.
16. UK Standards for microbiology investigations bacteriology. Identification of Haemophilus species and the HACEK group of organisms, 2015, N 3, 35 p.
17. Centers for Disease Control and Prevention. Identification and characterization of Haemophilus influenzae. Режим доступа: https://www.cdc.gov/ meningitis/lab-manual/chpt09-id-characterization-hi. html (дата обращения: 13.03.2017).
18. Granick S., Gilder H. // J. Gen. Physiol. 1946. Vol. 30, pp. 1-13.
19. Schmidt-Brauns J., Herbert M., Kemmer G., Kraiss A., Schlör S., Reidl J. // Int. J. Med. Microbiol. 2001. Vol. 291. N 3, pp. 219-225.
20. Månsson V., Resman F., Kostrzewa M., Nilson B., Riesbeck K. // J. Clin. Microbiol. 2015. Vol. 53. N 7, pp. 2215-2224.
21. Салимова Е.Л., Конон А.Д., Трухин В.П., Петровский С.В., Красильников И.В. // Актуальная биотехнология. 2016. № 3 (18). С. 77-81.
22. Takagi M., Cabrera-Crespo J., BaruqueRamos J., Zangirolami T.C., Raw I., Tanizaki M.M. // Appl. Biochem. Biotechnol. 2003. Vol. 110. N 2, pp. 91-100.
23. Esmaily F., Aminian M., Tavangar A.R., Hadi A. // Arch. Razi Instit. 2011. Vol. 66. N 1, pp. 43-49.
24. Maitre-Wilmotte G., Speck D., Rokbi B. Patent United States, N 8,673,617, 2014.
25. Arsang A., Tabatabaie A., Vaziri F., Nejati M., Zolfaghari M. R., Fateh A., Rahimi Jamnani F., Bahrmand A. R., Siadat S. D. // Minerv. Biotecnolog. 2017. Vol. 29. N 1, pp. 17-23.
26. American type culture collection. Haemophilus influenzae (Lehmann and Neumann).
Салимова Е. Л., Конон А. Д., Трухин В. П., Красильников И. В.
ВЕСТНИК ВГУ, СЕРИЯ: ХИМИЯ. БИОЛОГИЯ. ФАРМАЦИЯ, 2019, № 1
МИРОВЫЕ ТЕНДЕНЦИИ В ИЗОЛЯЦИИ, ИДЕНТИФИКАЦИИ И ХАРАКТЕРИСТИКЕ HAEMOPHILUS INFLUENZAE ТИП B – ВОЗБУДИТЕЛЯ ГЕМОФИЛЬНОЙ ИНФЕКЦИИ
Поделиться ссылкой: